Субмукозните тумори (СМТ) на стомашно-чревния тракт са издигнати лезии, произхождащи от мускулната лигавица, субмукозата или мускулната проприя, и могат да бъдат и екстралуменни лезии. С развитието на медицинските технологии, традиционните хирургични възможности за лечение постепенно навлизат в ерата на минимално инвазивното лечение, като например лапароскопска хирургия и роботизирана хирургия. В клиничната практика обаче може да се установи, че „хирургията“ не е подходяща за всички пациенти. През последните години стойността на ендоскопското лечение постепенно получава внимание. Публикувана е последната версия на китайския експертен консенсус относно ендоскопската диагностика и лечение на системна мозъчна травма (СМТ). Тази статия ще представи накратко съответните знания.
1. Епидемичен характер на SMTристика
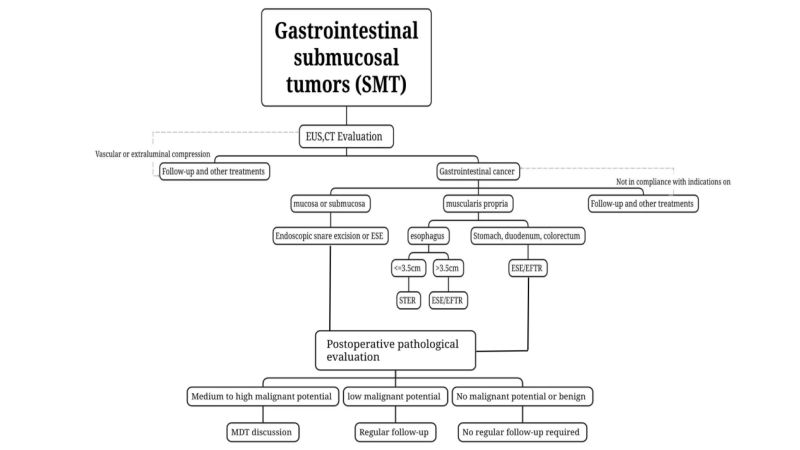
(1) Честотата на SMТ е неравномерно разпределен в различни части на храносмилателния тракт, а стомахът е най-честото място за SMT.
Честотата на различнитеРазпределението на отделните части на храносмилателния тракт е неравномерно, като горният храносмилателен тракт е по-често срещан. От тях 2/3 се намират в стомаха, следвани от хранопровода, дванадесетопръстника и дебелото черво.
(2) Хистопатологичните данниВидовете SMT са сложни, но повечето SMT са доброкачествени лезии и само няколко са злокачествени.
A.SMT не включваn-неопластични лезии като ектопична панкреатична тъкан и неопластични лезии.
Б. Сред неопластичната лезияs, стомашно-чревните лейомиоми, липомите, бруцелозните аденоми, гранулозно-клетъчните тумори, шваномите и гломусните тумори са предимно доброкачествени и по-малко от 15% могат да се проявят като тъканно зло.
C. Стомашно-чревна стромаТуморите (GIST) и невроендокринните тумори (NET) при SMT са тумори с определен злокачествен потенциал, но това зависи от техния размер, местоположение и вид.
Г. Местоположението на SMT е свързанокъм патологичната класификация: а. Лейомиомите са често срещан патологичен тип СМТ в хранопровода, представляващи 60% до 80% от езофагеалните СМТ и е по-вероятно да се появят в средните и долните сегменти на хранопровода; б. Патологичните видове СМТ на стомаха са относително сложни, с ГИСТ, лейомиомМатомиомата и ектопичният панкреас са най-често срещаните. Сред стомашните SMT, GIST се среща най-често във фундуса и тялото на стомаха, лейомиомът обикновено се намира в кардията и горната част на тялото, а ектопичният панкреас и ектопичният панкреас са най-често срещани. Липомите са по-чести в антрума на стомаха; в. Липомите и кистите са по-чести в низходящите и луковичните части на дванадесетопръстника; г. При SMT на долния стомашно-чревен тракт, липомите са преобладаващи в дебелото черво, докато невроендокринните тумори (НЕТ) са преобладаващи в ректума.
(3) Използвайте компютърна томография и ядрено-магнитен резонанс (КТ) и магнитно-резонансна томография (ЯМР) за класифициране, лечение и оценка на тумори. За спонтанни туморни тумори (СМТ), за които се подозира, че са потенциално злокачествени или имат големи тумори (дългидиаметър > 2 см), се препоръчват компютърна томография (КТ) и ядрено-магнитен резонанс (ЯМР).
Други образни методи, включително компютърна томография и ядрено-магнитен резонанс, също са от голямо значение за диагностицирането на системния мезенхимален тумор (СМТ). Те могат директно да покажат местоположението на тумора, модела на растеж, размера на лезията, формата, наличието или отсъствието на лобулация, плътността, хомогенността, степента на усилване и граничния контур и др., както и да установят дали и степента на дебелина.ене на стомашно-чревната стена. По-важното е, че тези образни изследвания могат да открият дали има инвазия на съседните структури на лезията и дали има метастази в околния перитонеум, лимфни възли и други органи. Те са основният метод за клинично класифициране, лечение и оценка на прогнозата на туморите.
(4) Вземането на тъканни проби не се препоръчваПрепоръчва се за доброкачествени спонтанни тумори на панкреаса (СМТ), които могат да бъдат диагностицирани чрез конвенционална ендоскопия, комбинирана с ендоскопско ултразвуково изследване (EUS), като липоми, кисти и ектопичен панкреас.
За лезии, за които се подозира, че са злокачествени, или когато конвенционалната ендоскопия, комбинирана с ендоскопски ултразвук (EUS), не може да оцени доброкачествените или злокачествените лезии, може да се използва тънкоиглена аспирация/биопсия, насочена с EUS (ендоскопска ултрасонография).Иглена аспирация/биопсия, EUS-FNA/FNB), биопсия от лигавичен инцизион (биопсия, асистирана с мукозален инцизион, MIAB) и др. извършват вземане на биопсични проби за предоперативна патологична оценка. С оглед на ограниченията на EUS-FNA и последващото въздействие върху ендоскопската резекция, за тези, които отговарят на условията за ендоскопска хирургия, при условие че се гарантира, че туморът може да бъде напълно отстранен, отделенията със зряла ендоскопска технология за лечение могат да бъдат лекувани от опитен ендоскопист. Ендоскопистът извършва ендоскопска резекция директно, без да поставя предоперативна патологична диагноза.
Всеки метод за получаване на патологични проби преди операция е инвазивен и ще увреди лигавицата или ще причини адхезия към субмукозната тъкан, като по този начин ще увеличи трудността на операцията и евентуално ще увеличи риска от кървене, перфорация.рациониране и разпространение на тумора. Следователно, предоперативната биопсия не е непременно необходима. Необходима е, особено за SMT, които могат да бъдат диагностицирани чрез конвенционална ендоскопия, комбинирана с EUS, като липоми, кисти и ектопичен панкреас, като не се изисква вземане на тъканни проби.
2.SMT ендоскопско лечениеnt
(1) Принципи на лечение
Лезиите, които нямат метастази в лимфните възли или имат много нисък риск от метастази в лимфните възли, могат да бъдат напълно резецирани с помощта на ендоскопски техники и имат нисък риск от остатъчна поява и рецидив, са подходящи за ендоскопска резекция, ако е необходимо лечение. Пълното отстраняване на тумора минимизира остатъчния тумор и риска от рецидив.По време на ендоскопската резекция трябва да се спазва принципът на лечение без тумор и да се осигури целостта на туморната капсула по време на резекцията.
(2) Показания
i. Тумори със злокачествен потенциал, заподозрени чрез предоперативен преглед или потвърдени чрез биопсична патология, особено тези, заподозрени в гастроинтестинален произходСТ с предоперативна оценка на дължина на тумора ≤2 см и нисък риск от рецидив и метастази, и с възможност за пълна резекция, могат да бъдат ендоскопски резецирани; за тумори с голям диаметър. При съмнение за ГИСТ с нисък риск >2 см, ако лимфните възли или отдалечените метастази са били изключени от предоперативната оценка, при условие че се гарантира, че туморът може да бъде напълно резециран, ендоскопската хирургия може да се извърши от опитни ендоскописти в отделение със зряла ендоскопска технология за лечение. резекция.
ii. Симптоматична (напр. кървене, обструкция) SMT.
iii. Пациенти, чиито тумори се подозират като доброкачествени чрез предоперативен преглед или са потвърдени чрез патология, но не могат да бъдат проследявани редовно или чиито тумори се уголемяват за кратък период от време по време на периода на проследяване и които имат силно желаниеe за ендоскопско лечение.
(3) Противопоказания
i. Идентифицирайте лезиите, които ме засягатвкусът се наблюдава в лимфни възли или отдалечени места.
ii. За някои SMT с чиста лимфаnodeили отдалечени метастази, е необходима обемна биопсия, за да се получи патология, което може да се разглежда като относително противопоказание.
iii. След подробна предоперативнаоценката се установява, че общото състояние е лошо и ендоскопската операция не е възможна.
Доброкачествените лезии като липом и ектопичен панкреас обикновено не причиняват симптоми като болка, кървене и обструкция. Когато SМТ се проявява като ерозия, язва или бързо се увеличава за кратък период от време, като се увеличава вероятността тя да е злокачествена лезия.
(4) Избор на метод на резекцияd
Ендоскопска резекция на примка: ЗаАко SMT е относително повърхностен, стърчи в кухината, както е определено чрез предоперативни ултразвукови и компютърни изследвания, и може да бъде напълно резециран наведнъж с примка, може да се използва ендоскопска резекция с примка.
Местни и чуждестранни проучвания потвърждават, че е безопасен и ефективен при повърхностни SMT <2 см, с риск от кървене от 4% до 13% и перфорация.риск от 2% до 70%.
Ендоскопска субмукозна екскавация, ESE: За SMT с дълъг диаметър ≥2 cm или ако предоперативни образни изследвания като EUS и CT потвърждаватКогато туморът стърчи в кухината, ESE е осъществима за ендоскопска ръкавна резекция на критични SMT.
ESE следва техническите навици наендоскопска субмукозна дисекция (ESD) и ендоскопска мукозна резекция, като рутинно се използва кръгов „flip-top“ разрез около тумора, за да се отстрани лигавицата, покриваща SMT, и да се разкрие напълно туморът. , за да се постигне целостта на тумора, да се подобри радикалността на операцията и да се намалят интраоперативните усложнения. За тумори ≤1,5 cm може да се постигне пълна резекция от 100%.
Ендоскопска резекция с субмукозен тунелингйон, STER: За SMT, произхождащ от muscularis propria в хранопровода, хилуса, малката кривина на стомашното тяло, стомашния антрум и ректума, в които е лесно да се установят тунели, а напречният диаметър е ≤ 3,5 cm, STER може да бъде предпочитаният метод на лечение.
STER е нова технология, разработена на базата на перорална ендоскопска езофагеална сфинктеротомия (POEM) и е разширение на ESD технологията.нология. Честотата на en bloc резекция на STER за SMT лечение достига от 84,9% до 97,59%.
Ендоскопска резекция на пълна дебелинайон,EFTR: Може да се използва за SMT, където е трудно да се установи тунел или където максималният напречен диаметър на тумора е ≥3,5 см и не е подходящ за STER. Ако туморът стърчи под лилавата мембрана или расте извън част от кухината и се установи, че туморът е плътно прилепнал към серозния слой по време на операцията и не може да бъде отделен, може да се използва. EFTR извършва ендоскопско лечение.
Правилно зашиване на перфорациятаМястото на зашиване след EFTR е ключът към успеха на EFTR. За да се оцени точно рискът от рецидив на тумора и да се намали рискът от разпространение на тумора, не се препоръчва да се реже и отстранява резецираният туморен образец по време на EFTR. Ако е необходимо туморът да се отстрани на парчета, първо трябва да се поправи перфорацията, за да се намали рискът от посявка и разпространение на тумора. Някои методи за зашиване включват: шев с метална скоба, шев с вендуза, техника на зашиване с пластир на оментума, метод на "зашиване с торбичка" с найлоново въже, комбинирано с метална скоба, система за затваряне с метална скоба (скоба над ендоскопа, OTSC), шев OverStitch и други нови технологии за възстановяване на стомашно-чревни наранявания и справяне с кървене и др.
(5) Следоперативни усложнения
Интраоперативно кървене: Кървене, което води до спадане на хемоглобина на пациента с повече от 20 g/L.
За да се предотврати масивно интраоперативно кървене,По време на операцията трябва да се направи достатъчно субмукозна инжекция, за да се оголят по-големите кръвоносни съдове и да се улесни електрокоагулацията за спиране на кървенето. Интраоперативното кървене може да се лекува с различни ножове за инцизии, хемостатични щипки или метални скоби, както и с превантивна хемостаза на откритите кръвоносни съдове по време на дисекция.
Следоперативно кървене: Следоперативното кървене се проявява като повръщане на кръв, мелена или кръв в изпражненията. В тежки случаи може да възникне хеморагичен шок. Най-често се случва в рамките на 1 седмица след операцията, но може да се появи и 2 до 4 седмици след операцията.
Следоперативното кървене често е свързано сфактори като лош постоперативен контрол на кръвното налягане и корозия на остатъчните кръвоносни съдове от стомашна киселина. Освен това, постоперативното кървене е свързано и с местоположението на заболяването и е по-често срещано в стомашния антрум и долната част на ректума.
Забавена перфорация: Обикновено се проявява като подуване на корема, влошаване на коремната болка, признаци на перитонит, треска, а образното изследване показва натрупване на газове или повишено натрупване на газове в сравнение с преди.
Това е свързано най-вече с фактори като лошо зашиване на рани, прекомерна електрокоагулация, твърде ранно ставане за движение, твърде ранно хранене, лош контрол на кръвната захар и ерозия на раните от стомашна киселина. а. Ако раната е голяма или дълбока или раната е фиброзна.При промени, подобни на сигурни, времето за почивка на легло и времето за гладуване трябва да бъдат удължени по подходящ начин и да се извърши стомашно-чревна декомпресия след операция (пациентите след операция на долния стомашно-чревен тракт трябва да имат дренаж на аналния канал); а. Пациентите с диабет трябва стриктно да контролират кръвната си захар; тези с малки перфорации и леки гръдни и коремни инфекции трябва да получат лечение като гладуване, противоинфекциозни средства и потискане на киселинността; в. При тези с излив може да се извърши затворен гръден дренаж и коремна пункция. Трябва да се поставят тръби, за да се поддържа гладко дрениране; г. Ако инфекцията не може да бъде локализирана след консервативно лечение или е комбинирана с тежка торакоабдоминална инфекция, трябва да се извърши хирургична лапароскопия възможно най-скоро, както и да се извърши възстановяване на перфорацията и коремен дренаж.
Усложнения, свързани с газове: Включително подкожнинеозен емфизем, пневмомедиастинум, пневмоторакс и пневмоперитонеум.
Интраоперативен подкожен емфизем (проявяващ се като емфизем на лицето, шията, гръдната стена и скротума) и медиастинален пневмофизем (сподуване на епиглотиса може да се открие по време на гастроскопия) обикновено не изискват специално лечение и емфиземът обикновено отшумява сам.
Възниква тежък пневмоторакспо време на операция [налягането в дихателните пътища надвишава 20 mmHg по време на операцията
(1 mmHg = 0,133 kPa), SpO2 < 90%, потвърдено чрез спешна рентгенография на гръдния кош], операцията често може да продължи след затворена евакуация на гръдния кошвъзраст.
При пациенти с видим пневмоперитонеум по време на операцията, използвайте игла за пневмоперитонеум, за да пробиете точката на Макфарланд.в дясната долна част на корема, за да се изпусне въздухът, и оставете иглата за пункция на място до края на операцията, след което я извадете, след като се уверите, че не се отделя видим газ.
Стомашно-чревна фистула: Храносмилателната течност, причинена от ендоскопска хирургия, попада в гръдната или коремната кухина чрез теч.
Езофагеалните медиастинални фистули и езофаготоракалните фистули са често срещани. След появата на фистула, извършете затворен дренаж на гръдния кош, за да поддържатеосигуряват гладък дренаж и адекватна хранителна поддръжка. Ако е необходимо, могат да се използват метални скоби и различни затварящи устройства или пълното покритие може да се рециклира. Стентове и други методи се използват за блокиранефистула. Тежките случаи изискват незабавна хирургическа интервенция.
3. Следоперативно управление (fпоследващо действие)
(1) Доброкачествени лезии:Патологияпредполага, че доброкачествените лезии като липом и лейомиом не изискват задължително редовно проследяване.
(2) СМТ без злокачественипотенциал на мравките:Например, при ректални НЕТ 2 см и ГИСТ със среден и висок риск, трябва да се извърши пълно стадиране и да се обмислят допълнителни лечения (хирургия, химиолъчетерапия, таргетна терапия). Формулирането на плана трябва да се основава на мултидисциплинарна консултация и на индивидуална основа.
(3) СМТ с нисък злокачествен потенциал:Например, нискорисковите ГИСТ трябва да се оценяват чрез ендоскопски ултразвук или образна диагностика на всеки 6 до 12 месеца след лечението и след това да се лекуват съгласно клиничните инструкции.
(4) СМТ със среден и висок злокачествен потенциал:Ако постоперативната патология потвърди стомашен НЕТ тип 3, колоректален НЕТ с дължина >2 см и ГИСТ със среден и висок риск, трябва да се извърши пълно стадиране и да се обмислят допълнителни лечения (хирургия, химиолъчетерапия, таргетна терапия). Формулирането на плана трябва да се основава на[за нас 0118.docx]мултидисциплинарна консултация и индивидуално.
Ние, Jiangxi Zhuoruihua Medical Instrument Co., Ltd., сме производител в Китай, специализиран в ендоскопски консумативи, като напримерщипци за биопсия, хемоклип, полипна примка, игла за склеротерапия, спрей катетър, цитологични четки, направляваща тел, кошница за събиране на камъни, катетър за назален жлъчен дренажи др., които се използват широко вЕлектронна медицинска измервателна уредба (ЕМР), електростатично разреждане,ЕРХПГНашите продукти са сертифицирани по CE, а нашите заводи са сертифицирани по ISO. Нашите стоки са изнасяни в Европа, Северна Америка, Близкия изток и част от Азия и получават широко признание и похвала от клиентите!
Време на публикуване: 18 януари 2024 г.


